- .
- Perché QualiWare?
-
-
Scopri perchè
Accelera la complianceLa certezza di adempiere alle normative correnti in maniera completa ed ottimizzata.
Risolve adessoAnticipa la concorrenza ed intervieni sulle esigenze aziendali con efficienza e in tempi ridotti.
Evolve con teIl nostro reparto R&D sviluppa continuamente nuove funzionalità o implementazioni per migliorare le performance di QualiWare.
Piattaforma low-codeScopri perché QualiWare è la piattaforma low-code ideale per digitalizzare in autonomia i processi aziendali.
-
Scopri di più
Cos’è QualiWareUn software, infinite opportunità. Gestisci, ottimizza e concretizza le tue esigenze di business grazie ad un applicativo agile e modulare.
Confronto con altre soluzioniSentiti sicuro di affidare il tuo business a QualiWare confrontandolo con gli altri applicativi sul mercato!
Scopri le integrazioniIl lavoro di squadra premia sempre! QualiWare si integra con i tuoi applicativi aziendali e da questi trae la sua forza.
Il nostro metodoIl metodo che ci consente di accompagnare le aziende nella trasformazione digitale dei loro processi.
-
Scopri i nostri servizi
Analisi e SviluppoNon sei solo! Ti offriamo la consulenza dei nostri migliori esperti per integrare QualiWare nella tua azienda e per sviluppare soluzioni personalizzate.
Assistenza di espertiChiamaci o scrivici. Siamo a tua disposizione per qualsiasi evenienza.
Programma QISQualiWare Improvement Service. Il servizo che comprende help-desk e aggiornamento software.
-
La soluzione che fa per te
-
-
- Moduli
-
-
Scopri le funzionalità di Qualiware
Form DesignerCrea documenti semplicemente, rapidamente e in totale autonomia.
Gestione DocumentaleOttimizza i tempi relativi alla gestione documentale e riduci il rischio di errore.
QualiWare Check-ListEffettua controlli regolari sui sistemi qualità e crea checklist personalizzate.
Questionari, indicatori e dashboardMisura e monitora i dati importanti e crea le tue dashboard ed indicatori.
NC/AC, segnalazioni e reclamiAnalizza e rispondi ai reclami e le non conformità, monitorando le informazioni.
Gestione Risorse UmaneScopri come gestire e controllare facilmente i dati professionali del personale.
Progetti e commesseGestisci al meglio commesse e progetti con grafici personalizzati e stato avanzamento lavori.
Strumenti e ManutenzioneMonitora le attrezzature e gestisci la manutenzione degli strumenti.
Controllo in accettazioneScopri tutti i moduliMonitora le informazioni e organizza una gestione ottimizzata delle non conformità.
-
La funzionalità custom
Non sei riuscito a trovare una funzionalità per soddisfare le esigenze della tua azienda? Pensi che nessuno dei nostri moduli sia in grado di rispondere alle tue necessità?
Confrontiamoci per trovare insieme una soluzione
-
-
- Clienti
-
-
Case history
Chemgas 4.0. Raccogliere e Digitalizzare.Gestione dei macchinari ed eliminazione della carta.
Alpego riorganizza il lavoro. Parola d'ordine: Autonomia.Gestione del magazzino e degli ordini di produzione.
Galletti Spa investe nelle proprie persone.Scopri tutte le case historyGestione e archiviazione della documentazione HR.
-
Settori
VitivinicoloGestisci efficientemente le attività e porta la tua cantina ad un livello superiore.
AutomotiveOttimizza i processi aziendali e diminuisci gli sprechi di tempo e di risorse economiche.
Sviluppo SostenibileScopri tutti i settoriGesitisci efficacemente la sostenibilità dei processi in azienda calcolando le emissioni e individuando gli sprechi.
-
Normative
QUALITÀ ISO 9001Ottimizza la gestione della Qualità per avere il pieno controllo delle informazioni e dei dati presenti in azienda.
AMBIENTE ISO 14001Adempi ai requisiti di gestione ambientale, risparmiando risorse e archiviando la documentazione.
Sicurezza D.LGS 81/2008 E ISO 45001Scopri tutti le normativeGestisci la sicurezza in azienda e tieni traccia di tutta la documentazione aziendale, Associando rischi e obiettivi.
-
Guarda QualiWare in azione
Richiedi una Demo e scopri come QualiWare può aiutare la tua azienda a digitalizzare, ottimizzare e gestire in autonomia tutte le attività legate a Qualità, Sicurezza, Ambiente e Sistema Documentale.
Richiedi demo
-
-
- Risorse
-
-
Approfondisci
NewsRimani sempre aggiornato con le ultime news del settore.
Tips & TricksI nostri consigli e i nostri avvisi per guidarti all'uso ottimale dei nostri prodotti.
VideoI nostri video tutorial e demo per illustrarti al meglio le potenzialità della suite QualiWare.
Agevolazioni del PNRRScopri come digitalizzare i tuoi processi aziendali con QualiWare usufruendo delle agevolazioni del PNRR.
-
Connettiti
EventiUna sezione dedicata agli eventi QualiWare sia fisici che virtuali.
ForumAccedi al nostro Forum, esponi le tue domande, scarica aggiornamenti e consulta la documentazione tecnica.
QualiWare AcademyUna piattaforma e-Learning e ben due sezioni dedicate per formarti ed informarti!
-
-
Scopri gli articoli in evidenza
- Diventa anche tu un Qualihero: iscriviti alla community ufficiale di Qualiware
- Rifiuti aziendali e R.E.N.T.Ri.: affronta il cambiamento con QW-RUSCO
- Scopri come utilizzare l’AI in Qualiware al corso del 26 giugno 2025
- Saremo presenti alla 64° edizione del Simposio AFI
- Partecipa al webinar “L’intelligenza artificiale al servizio della compliance e della sostenibilità”
- OpenHouse 2025: il 29 maggio festeggiamo i nostri primi trent’anni!
- Ti aspettiamo alla Settimana della Sostenibilità
- Compliance Day 2025
-
-
-
- Azienda
-
-
Qualcosa di noi
La nostra storiaDagli esordi, nel 1995, fino alle ultime novità.
CertificazioniScopri i riconoscimenti che testimoniano il nostro costante impegno
PartnershipGarantiamo ai nostri clienti servizi d’eccellenza
Analysis extraOltre la digitalizzazione dei processi.
PubblicazioniPromuoviamo e diffondiamo la cultura digitale
-
La nostra mission
Affianchiamo le aziende che vogliono essere indipendenti nella digitalizzazione dei propri processi organizzativi e legati alla compliance.
Scopri la nostra soluzione
-
-
- F.A.Q.
- Contattaci
- Richiedi demo
- .
- .
Assicura l'integrita e la sicurezza del dato.
Annex 11 EU GMP & 21 CFR Part 11
L’ Annex 11 EU GMP è un regolamento richiedente che i sistemi informatici operanti in ambiti regolamentati come il settore farmaceutico, siano convalidati e abbiano una l’Infrastruttura IT qualificata. Mentre il 21 CFR Part 11 è un regolamento voluto per certificare l’integrità e la sicurezza dei dati aziendali, in particolare per le aziende del settore farmaceutico. Lo scopo del regolamento infatti è conservare i dati in modo sicuro per impedire che vengano modificati o persi e allo stesso tempo tracciare ogni modifica del dato prima che esso sia pubblicato.
La prima parte del 21 CFR Part 11, si occupa delle registrazioni elettroniche e della conservazione dei dati, la seconda invece è inerente alle firme elettroniche. QualiWare, mette a disposizione gli strumenti opportuni per gestire Electronic Record ed Electronic Signature in conformità con Annex 1EU GMP e 21 CFR Part 11. La piattaforma è stata sviluppata con l’obiettivo di assicurare la gestione e l’archiviazione dei dati critici GMP in ottica “data integrity”.
Attraverso un apposito parametro di configurazione, è possibile definire quali categorie documentali dovranno gestire i dati critici GMP e su di esse si attiveranno automaticamente Audit Trail e Firma Elettronica Forte in linea con quanto richiesto dal regolamento.
Acquisire e conservare dati importanti.
Grazie alla flessibilità data dal Form Designer, QualiWare risulta essere lo strumento ideale per consentire alle aziende del settore farmaceutico e medicale la migrazione delle gestioni di dati critici effettuate con strumenti quali Excel ed Access e quindi difficilmente validabili secondo le suddette linee guida.
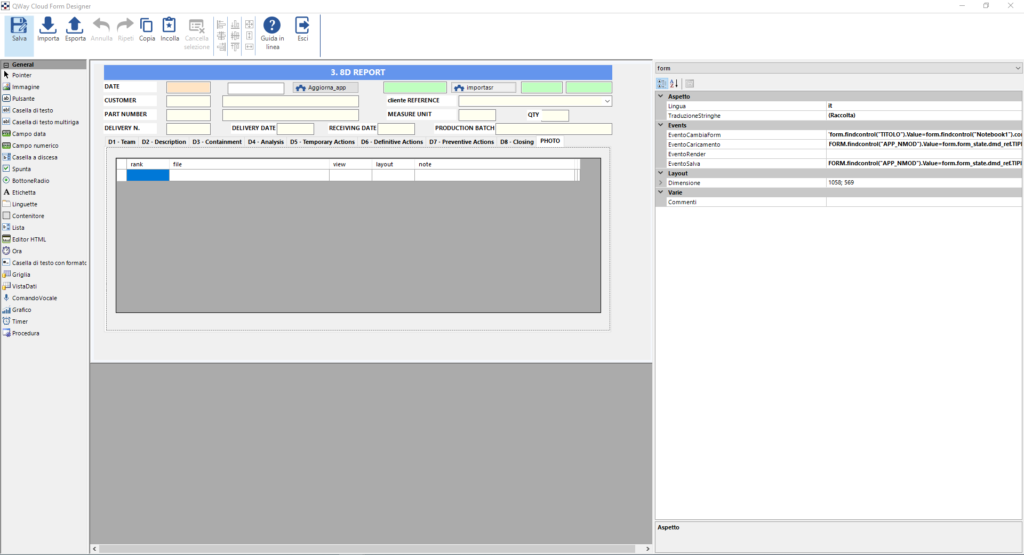
Per richiedere il White Paper con la descrizione dettagliata delle funzionalità di QualiWare e della piattaforma QWay in ambito Annex 11 EU GMP e 21 CFR Part 11, compila il modulo sottostante: